Uusin OPS:in mukainen KE2-kurssi on perusteiltaan erilainen kuin vanhan OPS:in mukainen KE2-kurssi. Viikin tapauksessa mielenkiintoiseksi teki ja osittain helpotuksen toi se, että uuden OPS:in mukaan kemian lukio-opinnot aloittaneet olivat KE1-kurssilla opiskelleet ainemäärään ja konsentraatioon liittyvät asiat (kuten KE1:ssa vanhan opetussuunnitelman mukaan oli).
KE2-kurssini arvioinnin sovimme rakentuvan seuraavien töiden tuloksiin:
- Animaatio (malli) kemian ilmiöstä (ChemSense Animator -ohjelmalla)
- Työselostus kokeellisesta työstä
- Isomeriaa koskeva essee (jossa todennettiin 3D-ohjelman osaaminen)
- Käsitetesti
Kurssin punainen lanka löytyy orbitaaliteoriasta (mistä kirjan nimikin on saanut innostuksen) ja hybridisaatiosta. Alkuaineiden ominaisuudet, hiiliyhdisteiden rakenteet, allotropia ja isomeriakin selittyy näillä teorioilla. Puhumattakaan ns. ulkoelektronien määräytymiseen liittyvät perusteet. Myöhemmin tulee vastaan lisää kemian ilmiöitä ja rakenteita, joita selitetään niin orbitaaliteorialla kuin hybridisaatioilla.
Atomi, atomin rakenne ja atomimallit
KE1-kurssilla on pohdittu atomimallien historiaa ja nykyaikaisen kvanttimekaanisen mallin merkitystä. Nykytietämyksen mukaan kvanttimekaaninen malli elää uutta murrosta, CERN:in hiukkasfysiikan ja antimaterian tutkimukset ovat vieneet standarditeoriaa sen äärirajoille, jopa saattavat asettaa sen perusoletuksia kyseenalaisiksi. Kemian opetuksessa. vaikka atomin ytimen rakenne ja siellä tapahtuvat ilmiöt eivät liitykään itse kemiallisiin reaktioihin ja ilmiöihin, koko atomin rakenteeseen liittyvät tutkimukset ja teoretisoinnit ovat mielekkäitä ja asiallisia lisiä kemian opetuksessa. 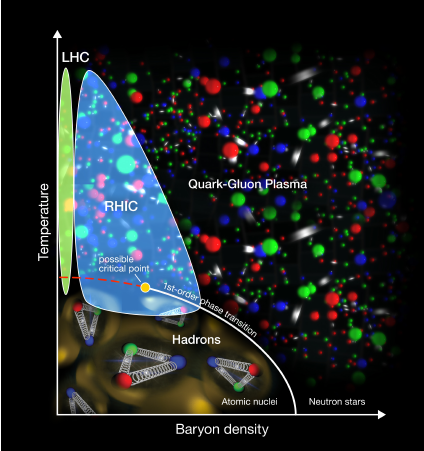
Aika, jolloin väitettiin, että neutroni on protonin ja elektronin yhdistelmä, on auttamattomasti historiaa. Myös se, että ydin muodostuu vain protoneista ja neutroneista, on historiaa. Kvarkki-gluoni-plasma -tutkimukset (katso kuva, lähde: http://www.phy.uct.ac.za/ctmp/research) saattavat antaa tulevaisuudessa melkoisesti uusia ajatuksia ja suuntia hiukkasfysiikan mallien rakentamisessa. Oman mielenkiinnon luo niin teoreettiset pohdiskelut kuin CERN:in tutkimukset Higgsin bosonin ja kentän osalta. Pohdiskelut elektronin olemuksesta (vrt. keskustelut aalto-hiukkasdualismista) ja massan synnyttävästä Higgsin kentästä antavat aiheen ja mahdollisuuden tulevaisuudessa miettiä selityksiä myös elektronien kahtalaisiin ominaisuuksiin. Kysymykset, voiko elektroni olla kahdessa eri paikassa samaan aikaan tai miten selitetään se, että voiko elektroni oikeasti esiintyä kuin massaton aalto ja toisaalta käyttäytyä selkeästi kuin massallinen hiukkanen, saavat vastauksia.
Atomin rakenne saa tässä kurssissa melkoisesti uusia ulottuvuuksia, kun elektroniverhon rakennetta jäsennetään orbitaaliteorian kautta. En osaa miettiä, miten muuten elektronitasoja ja hieman monimutkaisempia sidosteorioita ryhdyttäisiin selittämään.
Alkuaineiden luokittelua ja jaksollinen järjestelmä
Jako metalleihin ja epämetalleihin (sekä puolimetalleihin) on helppo selittää viittaamalla jaksolliseen järjestelmään. Mutta miksi ko. jako on olemassa ja miksi siitäkin on ollut erilaisia versioita (vrt. Aine ja energia -kirjan ja esim. Ilmiön jaksolliset järjestelmät). Mendelejevin r akentaman jaksollisen järjestelmän merkitys perustuu perusajatukseen, jossa ryhmät muodostuvat alkuaineista, joilla on samankaltaisia ominaisuuksia. Tämä pitää erityisen hyvin paikkansa 1) alkalimetallien, 2) maa-alkalimetallinen, 3) halogenidien ja 4) jalokaasujen kohdalla.
akentaman jaksollisen järjestelmän merkitys perustuu perusajatukseen, jossa ryhmät muodostuvat alkuaineista, joilla on samankaltaisia ominaisuuksia. Tämä pitää erityisen hyvin paikkansa 1) alkalimetallien, 2) maa-alkalimetallinen, 3) halogenidien ja 4) jalokaasujen kohdalla.
Muut ryhmät ovatkin sitten hieman pulmallisia, pääryhmistä 3-6 (Booriryhmästä happiryhmään) löytyy erilaisia alkuaineita, joilla on sekä metallien että epämetallien ominaisuuksia. Kuvassa on taas erilainen jako alkuaineisto ko. ryhmien osalta. Kurssin alkuun on hyvä tutustua (ellei jo tehty yläkoulussa tai KE1-kurssilla) www.ptable.com -sivustoon. Ko. sivusto sisältää käytännössä kaiken tarpeellisen alkuaineisiin liittyvän tiedon.
Orbitaaliteoria: atomiorbitaalit ja jaksollinen järjestelmä (hapetusluvut)
Orbitaaliteoria on hyvää rakentaa kvanttilukujen pohjalle. Miten atomimalli energiatasoineen rakentuu ja selittyy erilaisilla kvanttiluvuilla on tärkeää. Kun orbitaalien määräytyminen on selvinnyt, ryhdytään pohtimaan orbitaalien ja energiatasojen täyttymistä. Em. ptable-sivuston hyödyntäminen orbitaalien täyttymisen määräytymistä koskevien sääntöjen määrittämisessä on ensiarvoisen tärkeää. Minimienergiaperiaatteen, Hundin säännön ja Paulin (kielto)säännön todentaminen ei ole hankalaa, mutta mm. kahden ”poikkeuksen” löytäminen johtaa mielenkiintoisiin keskusteluihin (sekä syistä että siitä, miten voidaan osoittaa sellaisten olemassa olo). Kromin ja kuparin erikoistapaukset vaatinevat oman pohdinnan – eivät ole aivan yksinkertaisia tapauksia (vrt. Madelungin sääntö).
Em. ptable-sivusto opastaa myös elektronikonfiguraatioiden laatimiseen. Tässä on kuitenkin todettava, että ko. sivuston elektronikonfiguraatioiden kirjoittamistapa noudattaa ideaa, jossa viimeisenä on aina se orbitaali, joka on viimeksi täyttämässä (ei siis välttämättä pääkvanttiluvun mukainen taso).
Hybridisaatio ja VSEPR-teoria
Orgaanisten yhdisteiden rakenteiden ymmärtäminen edellyttää hybridisaation ymmärtämistä. Sitä voidaan tukea VSEPR-teorian avulla. Netissä löytyy tähän tarkoitukseen erinomaisia videoita. Oma suosikki on: https://www.youtube.com/watch?v=keHS-CASZfc&t=44s . Hybridisaatio ja esim. hiilen allotropiat ovat oiva keino selittää molempien olemassaolo. Teoriaa hybridisaatiosta tukee myöhemmin myös pohdiskelut kompleksiyhdisteiden rakenteista ja avaruusgeometriassa.
Hiiliyhdisteet ja funktionaaliset ryhmät
Vanhan OPS:in mukaan otsikon teema käsiteltiin KE-kurssilla. Toki asia tuli uudestaan KE2-kurssilla, kun käsittelyyn tuli orgaanisten yhdisteiden avaruusrakenteet (orbitaalit ja hybridisaatio) ja isomeria. KE1-kurssilla uuden OPS:in mukaan hiiliyhdisteet tulevat lähinnä kovalenttisen sidoksen ja heikkojen sidoksien käsittelyn yhteydessä. Silloin tarpeellisten funktionaalisten ryhmien ymmärtäminen perustuu pitkälti yläkoulun kemian tuntemukseen. Elektronegatiivisuuden ja funktionaalisten ryhmien merkitys avautuu 3D-ohjelmien käytön avulla. Poolisuus ja elektronien sijoittumien molekyylissä onnistuu hyvin 3D-ohjelmien avulla (erilaiset elektronitiheydet saadaan näkyviin). Funktionaalisten ryhmien merkitys kemiallisissa ominaisuuksista todentuu ns. funktionaalisten ryhmien tunnistusreaktioissa (vrt. epäorgaanisten yhdisteiden, erityisesti metallien tunnistusreaktiot).
Aineen kaavan ja rakenteen määrittäminen, polttoanalyysi ja spektroskopia
Orbitaaliteorian vieminen käytäntöön onnistuu aineen kaavan ja rakenteen määrittämisen miettimisellä. Empiirisen kaavan (suhdekaava), molekyylikaavan ja lopuksi rakennekaavankin määrittämisessä spektroskopialla on suuri merkitys. Matemaattinen osuus empiirisen kaavan kohdalla antaa hyvän tilaisuuden kerrata moolimassan ja ainemäärän laskemista. Empiirisen kaavan määrityksen jälkeen on mahdollisuus paneutua tunnistusreaktioihin kokeellisella puolella tai syventyä spektroskopian alkeisiin niin IR:n kuin NMR:nkin osalta. Itse käytin jopa perikin tuntia spektroskopian opiskeluun, lukiolaiset laativat omat vertailutaulut IR-spektrien tulkintaa varten ja lopuksi selvitettiin sitä, miten NMR-spektrit mahdollistavat orgaanisten molekyylien rakenteen määrittämisen.
Isomeria
3D-mallintaminen nousee tärkeää rooliin juuri isomerian opetuksessa. Itse isomerian ymmärtäminen ei ole vaikea asia, mutta asioiden hahmottaminen helpottuu huomattavasti 3D-mallinnusohjelmien käytön avulla (soveltaen myös pallotikkumallien käytöllä). Itse toteutin isomerian tuntityöskentelyn lisäksi myös vaatimalla lukiolaisia tekemään esseet 3D-mallinnuksien kanssa.
Elämän rakennusaineet
Hiilihydraatit, proteiinit eli valkuaisaineet ym. muodostavat yhden ison kokonaisuuden jonka toteuttaminen voi hoitua monella tapaa. Otsikko on hieman lavea, mutta mahdollistaa pari- tai ryhmätyöskentelyssä rakennettujen teemojen läpikäymisen. Voi toimia myös vertaisarvioinnin kautta arvioitujen postereiden kokoamisena.