Tunnin aikana kerrattiin hapettuminen ja pelkistyminen. Kysehän on elektronien siirtymisistä atomilta toiselle. Jatkossa on tärkeää hallita eri yhdisteissä olevien alkuaineiden hapetusluvut – reaktioyhtälöiden kertoimien märittelyssä näitä tarvitaan. Tunnilla kerrattiin hapetuslukujen määräytymistä koskevat säännöt, jotka olivat olleet KE2-kurssilla esillä. Suurin osa säännöistä selviää jaksollisen järjestelmän avulla – alkalimetalli (ryhmä I) muodostaa yhdisteitä hapetusluvulla +I, halogeenit (ryhmä VII) vastaavasti hapetusluvulla -I. Atomit pyrkivät siis jalokaasurakenteeseen. Hapetuslukujen määräytymisessä on lukuisia syitä, suurimman osan voi perutella orbitaaliteorian avulla. Orbitaaliteoria antaa paremman ja yksityiskohtaisemman kuvan elektroniverhon rakenteessa ja näin ollen hapetuslukujen mahdollisista arvoista. 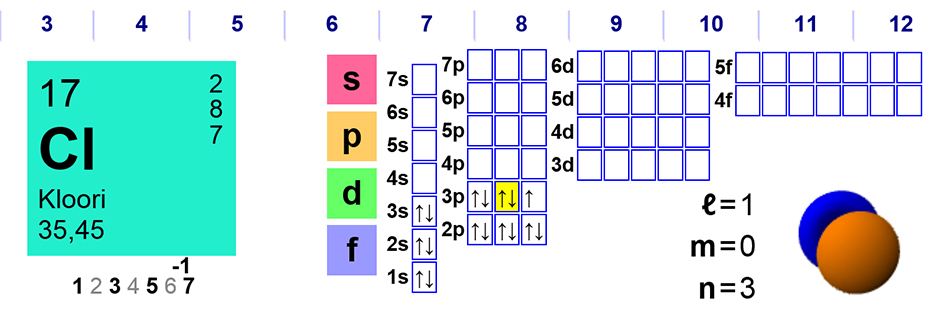 Tunnilla yhtenä esimerkkinä käsiteltiin kloori Cl. Viereisessä kuvassa on kloorin elektronijakaumakaavio. Atomin 3. energiatason p-orbitaalit ovat täyttymässä. Kloori muodostaa yhdisteitä m. hapetusluvuilla -I (kloridit), +III (kloriitit), +V (kloraatit) ja +VII (perkloraatit) Kloorin positiivisella hapetusluvulla muodostamat yhdisteet (kloraatit ja kloriitit) ovat voimakkaita hapettimia. Käytetään mm. valkaisuaineina. Kaikki hapetusluvut ovat kohtuudella selitettävissä orbitaalien tyhjentymisenä (positiiviset) tai parittomien elektronien jäämisenä eri orbitaaleilla. Negatiivinen hapetusluku selittyy jalokaasurakenteen toteutumisella.
Tunnilla yhtenä esimerkkinä käsiteltiin kloori Cl. Viereisessä kuvassa on kloorin elektronijakaumakaavio. Atomin 3. energiatason p-orbitaalit ovat täyttymässä. Kloori muodostaa yhdisteitä m. hapetusluvuilla -I (kloridit), +III (kloriitit), +V (kloraatit) ja +VII (perkloraatit) Kloorin positiivisella hapetusluvulla muodostamat yhdisteet (kloraatit ja kloriitit) ovat voimakkaita hapettimia. Käytetään mm. valkaisuaineina. Kaikki hapetusluvut ovat kohtuudella selitettävissä orbitaalien tyhjentymisenä (positiiviset) tai parittomien elektronien jäämisenä eri orbitaaleilla. Negatiivinen hapetusluku selittyy jalokaasurakenteen toteutumisella.