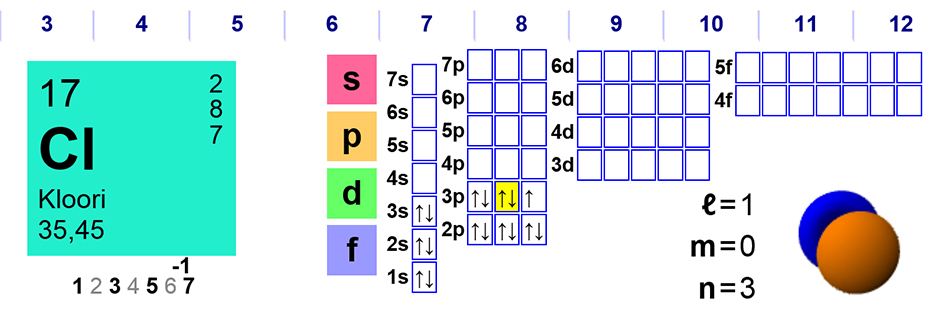
Tänään kotitehtävien läpikäynti oli tarkkaa – hapetuslukujen määrittämistä eri yhdisteissä ja muutamassa hieman vaikeammassa yhdisteessä.
Na2S2O3 , tiosulfaatin tapauksessa todettiin, että kun pidetään kiinni siitä, että natriumilla hapetusluku on +I ja hapella -II, rikin hapetusluvuksi tulisi +IV (tiosultaatti-ionin varaus on 2-). Rikin elektronirakenteen perusteella tämä perusteleminen voi olla hankalaa (voisi tietenkin olettaa rikki luovuttaa 3p-orbitaalin elektronit). Kuitenkin toinen mahdollisuus on se, että yksi rikki-atomi käyttäytyy (ja hapetusluku määräytyy) sen mukaan, että rikki-atomi korvaa yhden happiatomin sulfaatti-ioni -molekyylissä (rikki kuuluu samaan ryhmään hapen kanssa). Jolloin voimme päätellä, että yksi rikki saa hapetusluvukseen -II ja toinen rikki, kuten sulfaatti-ionissa, hapetusluvun +VI.
Toinen case oli KO2, jossa voimme hyvin olettaa, että kaliumin hapetusluku on +I (alkalimetalli), jolloin superoksidille O2- jää hapetusluku -I. Miten tämä jakautuu kahden appiatomin kesken onkin sitten pulmallista.
Kolmas case oli magnetiitti eli Fe3O4, jonka hapetusluvut voidaan selittää sillä, että kyseessä onkin seos FeO-Fe2O3, jossa rauta siis esiintyy kahdella eri hapetusluvulla +II ja +III.
Tunnin lopulla tutustuttiin tapaukseen, jossa mangaanin pitoisuuksia voidaan tutkia hapettamalla magnaani(II)-ionia permanganaatti-ioniksi (MnO4–) ja kun hapettimena käytetään kaliumperjodaattia (KIO4), joka muuttuu jodaatiksi (IO3–), voidaan rakentaa reaktioyhtälö hapettumis-pelkistymisreaktiolle. Ja tässä opeteltiin käyttämään hapetuslukuja ja osareaktioita.
 kuparinaula ja magnesiumnauha sinkkikloridi-liuoksessa sekä rautanaula ja magnesiumnauha kuparisulfaatti-liuoksessa. Vasemman puoleisessa liuoksessa magnesiumnauha on käytännössä liuennut sinkkikloridiliuokseen. Oikean puoleisessa ilmiö on selkeämpi – vaalean sininen liuos (jossa on kupari-ioneja) on muuttunut keltaiseksi (Fe-ioneja) ja kupari pelkistynyt rautanaulan pintaan. Myös tässä liuoksessa magnesiumnauha on liuennut liuokseen.
kuparinaula ja magnesiumnauha sinkkikloridi-liuoksessa sekä rautanaula ja magnesiumnauha kuparisulfaatti-liuoksessa. Vasemman puoleisessa liuoksessa magnesiumnauha on käytännössä liuennut sinkkikloridiliuokseen. Oikean puoleisessa ilmiö on selkeämpi – vaalean sininen liuos (jossa on kupari-ioneja) on muuttunut keltaiseksi (Fe-ioneja) ja kupari pelkistynyt rautanaulan pintaan. Myös tässä liuoksessa magnesiumnauha on liuennut liuokseen.