IUPACin kansainvälinen kemian opetuksen konferenssi järjestetään joka toinen vuosi. Koko konferenssin ohjelma on luettavissa tästä linkistä. Viimeksi se järjestettiin vuonna 2022 Kapkaupungissa Etelä-Afrikassa. Kyseisen konferenssin matkaraporttini löytyy tästä.
27th IUPAC ICCE-konferenssin avajaiset 15.7.
Osallistujia konferenssissa oli yli 600 yli 50 maasta.

Avajaisjuhlallisuudet sisällä lukuisan määrän tervetulotoivotuksia eri toimijoiden toimesta. Olihan järjestäjä tahoina useampi yliopisto, sponsoreina paljon yrityksiä ja paikkana itse hotellikompleksi Royal Cliff Grand Hotel. Ennen avajaisia oli aamulla alkanut mikrokemian symposium 12. International Symposium on Microscale Chemistry ISMC (josta oma blokikirjoitus).
Keynote-luennon päivän päätteeksi piti Peter Mahaffy Kanadasta. Luennon otsikkona oli Chemistry Education Today for our 2050 World. Hän puhui mm. systeemiajattelusta (systems thinking), jota IUPAC on lanseerannut laajasti vastauksena mm. YK:n Agenda 2030 -teemoihin.

ICCE-konferenssin 2.päivä 16.7.
Chemistry and Science Teacher Education and Continuous Professional Development -teemaryhmä
Ensimmäinen luento tässä istunnossa käsitteli mikrokemiaa STEM-kontekstissa. Luennon piti Chatree Faikhamta Thaimaasta, otsikko oli: Small.Scale Chemistry drive STEM Learning Activities for Sustainable Development.

Chatree hahmotteli mikrokemian mahdollisuuksia ja sitä, miten se voisi tukea STEM-opetusta ja tuoda kemiaa myös arkipäivän ongelmiin.

Toisen luennon piti koko konferenssin toinen suomalainen, joskin etänä. Johanna Järvinen-Taubertin (LessonApp-nimisestä suomalaisesta koulutusalan vientiyrityksestä) aiheena oli: ”Enhancing learning in chemistry: engaging lessons and modern pedagogy to promote learning in Finland. Kyseinen yritys markkinoi suomalaista mallia ulkomaille, joten se myös näkyi esityksessä. Luennon sisältö ei aivan vastannut otsikkoa – sekä kemian opetuksen ja opettajakoulutuksen kuvaus poikkesi omasta näkemyksestä ja käytännöstä. Luennossa esitelty LessonApp -työkalu lienee tutustumisen arvoinen.

Innovative technology for chemistry education -teemaryhmä
Tässä teemaryhmässä luennoissa käsiteltiin mm. digitaalista monen pelattavaa lautapeliä nimeltä ChemPOV. Kuvassa pelillisyyden hyödyntämiseen liittyviä ulottuvuuksia koottuna.

Robert Buct puhui teköälyn antamista mahdollisuuksia kemian opetuksessa otsikolla: Using generative AI and critical reflection for better concept understanding. Hän suhtautui hyödyntämiseen myönteisesti ja kehotti ottamaan vakavasti tekoälyn mahdollisuudet, yleisössä epäilevät tuomaat nostivat esille tietenkin arvioinnin ja väärinkäytön. Hän kehotti rohkaisemaan oppijoita kysymään tekoälyltä vastauksia käsitteisiin ja niiden ymmärtämiseen. Keskustelu näistä ja yhdistämällä saatua aineistoa aikaisempaan omaan tietoon, tekoäly antaa uudenlaista materiaalia reflektoimiseen.

Näiden jälkeen päivän päätteeksi oli mahdollisuus tutustua konferenssin posterikokoelmaan.
ICCE-konferenssin 3.päivä 17.7.
Systems Thinking in Chemistry for Sustainability -symposium
Glenn Hurst kertoi kestävästä kehityksestä kemian opetuksessa – kuten moni muukin tässä symposiumissa. Tässä hän yhdistää pelillisyyden osaksi opetusta.

Luennoitsijat lähestyivät teemaa eri tavoin, nostaen IUPAC:in laajasti lanseeraaman systeemiajattelun kattokäsitteeksi.

Aihetta lähestyttiin niin YK:n kestävän kehityksen Agenda 30:n että vihreän kemian näkökulmasta. Eri maissa ”vihreä kemia” saa erilaisen konnotaation aikaiseksi, riippuen siitä, onko politiikassa mukana ”vihreä puolue”. Luennoissa haluttiin tuoda opetukseen holistista ulottuvuutta, ainerajat ylittävää, toimintaympäristön ja kontekstin huomioivaa. Systeemiajattelun huomioimista kemian opetuksesta on esitelty muutamalla dialla.

Suomessa on jo pitkään korostettu kontekstin hyödyntämistä kemian opetuksessa. Luennoissa pohdittiin myös kognitiivisen kuormituksen kasvua yhtenä rajoittavana tekijänä systeemiajattelun laajemmassa käytössä.
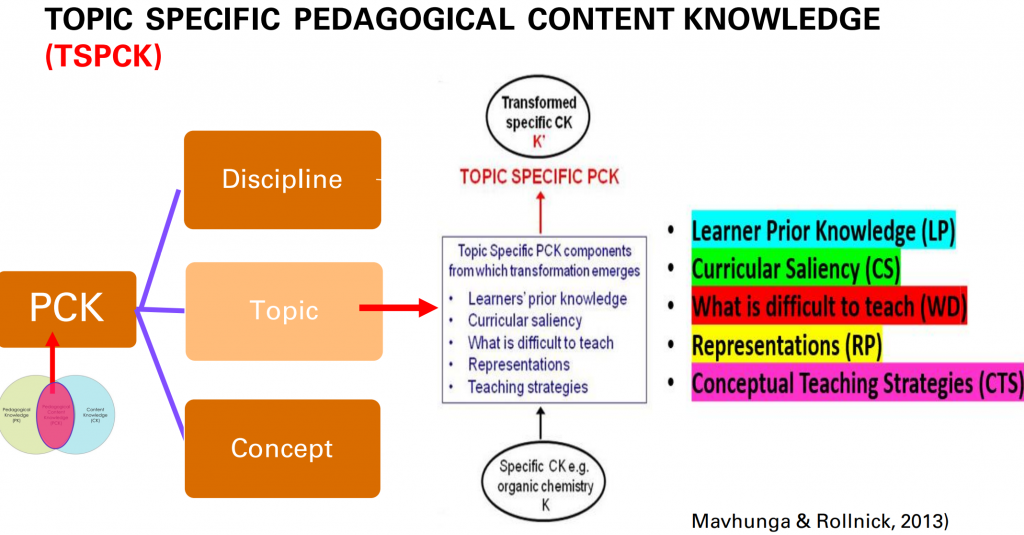
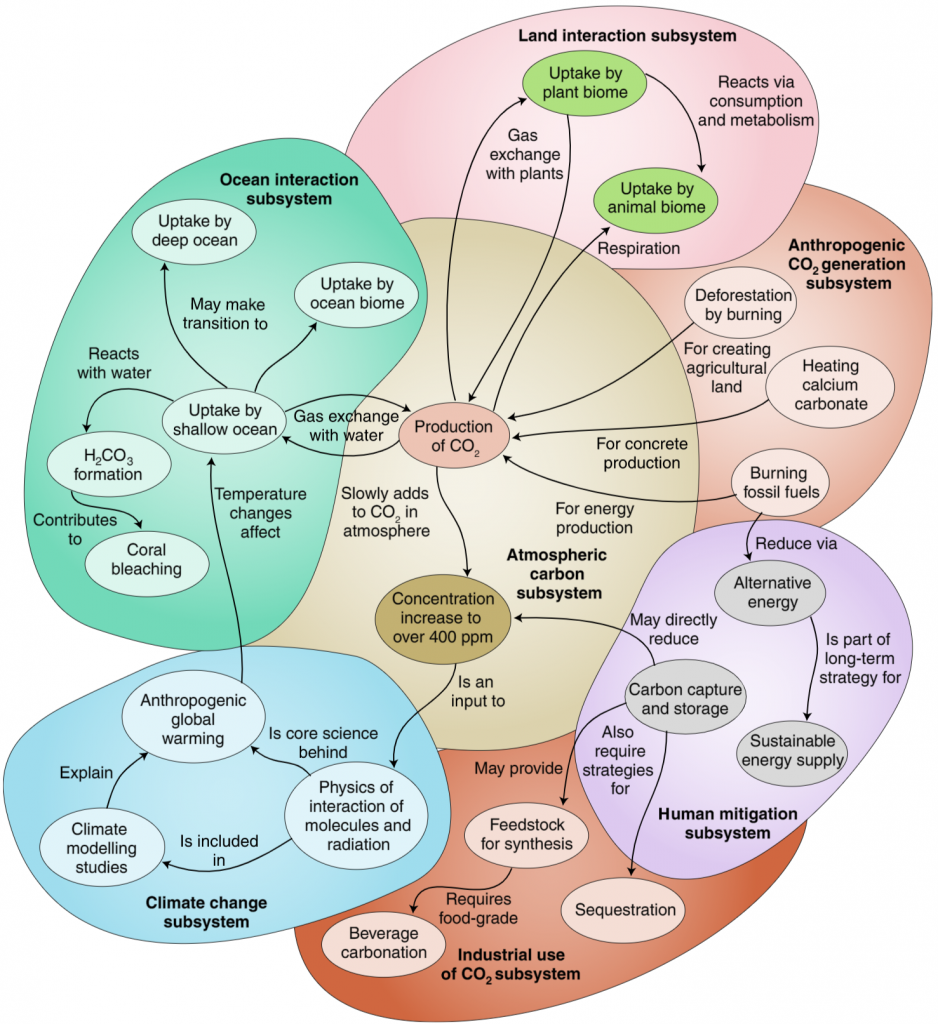
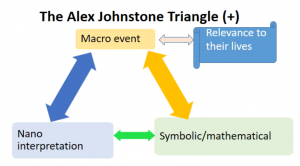
Seuraavat kuvat on Vicente Talanquerin ja David Laviskan USA:sta luennoista poimittuja.





Suomessa opetuksessa pohditaan digitaalisen osaamisen ja lukutaidon (nykyään lisäksi tekoälyn), ohjelmoinnillisen ajattelun (computational thinking) ja tiedekäytäntölähtöisen opetuksen (US: projektioppiminen) mahdollisuuksia kemian opetuksen kehittämisessä. Oman ulottuuden tähän on tuomassa nyt systeemiajattelu, jonka osin voisi ymmärtää kontekstuaalisen ja holistisen lähestymistavan synteesinä.
Suomessa systeemiajattelu ja sen paikkaa kemian opetuksessa on pohdittu Helsingin yliopiston kemianopetuksen yksikössä. Mm. ChemBio-messuilla oli paneelikeskustelu teemasta (jossa allekirjoittanut oli yhtenä panelistina).

ICCE-konferenssin 4.päivä 18.7.
Innovative tehnology for chemistry education -teemaryhmä (2.päivä)
Toisena teemaryhmän päivänä lähestyttiin hyvin eri näkökulmista ns. neljännen paradigman sisältöjä. Hyvin pintapuolisesti pohdittiin teköälyn, esineiden internetin ym. mahdollisuuksia kemian opetuksessa.


ICCE-konferenssin 5. ja päätöspäivä 19.7.
Emerging Educational Trends in Chemistry in the 21st Century
Päivän kaksi ensimmäistä alustusta pohti kemian symbolista kieltä ja reittiä onnistumiseen. Cole nosti esille Marzanon taksonomian opetuksen viitekehykseksi. Usein hyödynnetty Bloomin taksonomia tunnetaan sen selkeän hierarkkisen rakenteen ja kognitiivisiin prosesseihin keskittymisen vuoksi, Marzanon taksonomia taas tarjoaa integroidumman ja joustavamman lähestymistavan, joka sisältää oppimisen lisäulottuvuudet, kuten metakognition ja motivaation.

Chemistry and Chemical Science Education for Environmental and Social Sustainability
Umesh Ramnarain Johannesburgin yliopistosta esitteli Etelä-Afrikan oppikirjojen sisältöjä vihreän kemian näkökulmasta.

Päätöstilaisuus
Päätöstilaisuudessa esiteltiin seuraavan ICCE-konferenssin pitopaikka. Konferenssi järjestetään Turkissa yhdessä ECRICE-konferenssin kanssa.